UTILIDADES EN LA INDUSTRIA DE LOS ACIDOS CARBOXILICOS
REALIZADO POR:
MARIA ALEJANDRA PEÑA GARNICA
11-2T
ACIDOS CARBOXILICOS
Los ácidos carboxílicos tienen como fórmula general R-COOH. Tiene propiedades ácidas; los dos átomos de oxígeno sonelectronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones, una ruptura heterolítica cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.

PROPIEDADES QUIMICAS
El comportamiento químico de los ácidos carboxílicos esta determinado por el grupo carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones: pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo.
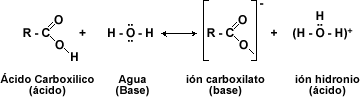
Los ácidos carboxílicos pueden ser desprotonados para formar aniones, los cuales son buenos nucleófilos en las reacciones SN2. Los ácidos carboxílicos experimentan ataques nucleófilos en su grupo carbonilo.
Las reacciones de los ácidos carboxílicos pueden agruparse en: sustitución, descarboxilación, desprotonación, reducción y sustitución nucleófila en el acilo.
Reacción de Hunsdiecker: Descarboxilación de Ácidos Carboxílicos.
En ciertas condiciones los ácidos carboxílicos experimentan descarboxilación, es decir, perdida de dióxido de carbono, para formar un producto que tiene un átomo de carbono menos que el ácido inicial. En la reacción de Hunsdiecker, que implica el calentamiento de la sal de un metal pesado del ácido carboxílico con bromo o con yodo, se pierde dióxido de carbono y se forma un halogenuro de alquilo con un átomo de carbono menos que el ácido inicial. El ión metálico puede ser plata, mercurio II o plomo IV, todos funcionan igualmente bien.
HgO, Br2, CCl4
CH3(CH2)15CH2COOH CH3(CH2)15CH2Br + CO2
Ácido octadecanoico 1-bromoheptadecano
Reducción de Ácidos Carboxílicos.
Los ácidos carboxílicos son reducidos por hidruros fuertes, como el hidruro de litio y aluminio, para formar alcoholes primarios. Sin embargo, la reacción es difícil, y con frecuencia se requiere calentamiento en tetrahidrofurano como solvente para que se complete.
El borano, BH3 también se utiliza para la conversión de ácidos carboxílicos en alcoholes primarios. La reacción de un ácido con borano ocurre con rapidez a temperatura ambiente, y a menudo se prefiere este procedimiento al de reducción LiAlH4 debido a su relativa seguridad, facilidad y especificidad. El borano reacciona en ácidos carboxílicos más rápido que con cualquier otro grupo funcional, de modo que permite realizar transformaciones selectivas como la que se muestra con ácidos p-nitrofenilacetico.
Sus estructuras hacen suponer que los ácidos carboxílicos sean moléculas polares y , tal como los alcoholes, pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas. Los ácidos carboxílicos se comportan en forma similar a los alcoholes en cuanto a sus solubilidades : los primeros cuatro son miscibles con agua, el ácido de cinco carbonos es parcialmente soluble y los superiores son virtualmente insolubles. La solubilidad en agua se debe a los puentes de hidrógeno entre el ácido carboxílico y el agua. El ácido aromático más simple, el benzoico, contiene demasiados átomos de carbono como para tener una solubilidad apreciable en agua.
Los ácidos carboxílicos son solubles en solventes menos polares, tales como éter, alcohol, benceno, etc. Los ácidos carboxílicos hierven a temperaturas aún más altas que los alcoholes. Estos puntos de ebullición tan elevados se deben a que un par de moléculas del ácido carboxílico se mantinen unidas no por un puente de hidrógeno sino por dos.
Los olores de los ácidos alifáticos inferiores progresan desde los fuertes e irritantes del fórmico y del acético hasta los abiertamente desagradables del butírico, valeriánico y caproico; los ácidos superiores tienen muy poco olor debido a sus bajas volatilidades.
Las sales de los ácidos carboxílicos son sólidos cristalinos no volátiles constituidos por iones positivos y negativos y su propiedades son las que corresponden a tales estructuras. Las fuerzas electrostáticas considerables que mantienen los iones en el retículo cristalino sólo pueden superarse por un calentamiento a temperatura elevada o por medio de un solvente muy polar. La temperatura requerida es tan alta que, antes de lograrla, se rompen enlaces carbono-carbono y se descompone la molécula, lo que sucede generalmente entre los 300-400°C. Raras veces es útil un punto de descomposición para la identificación de una substancia , puesto que, generalmente , refleja la rapidez del calentamiento que la identidad del compuesto.
nomenclatura
La IUPAC nombra los ácidos carboxílicos reemplazando la terminación -ano del alcano con igual número de carbonos por -oico.

Cuando el ácido tiene sustituyentes, se numera la cadena de mayor longitud dando el localizador más bajo al carbono del grupo ácido. Los ácidos carboxílicos son prioritarios frente a otros grupos, que pasan a nombrarse como sustituyentes.

Los ácidos carboxílicos también son prioritarios frente a alquenos y alquinos. Moléculas con dos grupos ácido se nombran con la terminación -dioico.

Cuando el grupo ácido va unido a un anillo, se toma el ciclo como cadena principal y se termina en
-carboxílico.

usos en la industria
Los ácidos grasos se utilizan para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería. El Acido Metanoico o Formico es el veneno de las hormigas
El Acido Butanoico o Butirico es propio de las mantequillas y le confiere ese sabor.
El Acido Etanoico o acetico es el bendito vinagre ni que decir mas.
El Acido Propanoico o Propionico es fermentador.
Acido Pentanoico o Acido Valerianico es la sustancia activa de la valeriana que es buena medicina para los nervios.
El Acido Tricarboxilico es la Vitamina C.
Una de las funciones más importante de los ác. carboxilicos se da con los que presentan mayor cantidad de átomos de Carbono. (aprox 18 a 25 át) conocidos como ácidos grasos. Estos forman junto con glicerol y restos de H3PO4 los fosfolipidos, que son los encargados de generar la pared celular de todas las celulas animales.
riesgos para la salud
· en la piel: Efecto cáustico en la piel y las mucosas.
· en el ojo: Fuerte efecto cáustico
· Ingestión: Puede ser nocivo por ingestión.
· Inhalación:
El material es extremadamente destructivo para los tejidos de las membranas mucosas y las vías
respiratorias superiores.
· Sensibilización: No se conoce ningún efecto sensibilizante.
· Datos adicionales (a la toxicología experimental): No se haben otros datos importantes
· Indicaciones toxicológicas adicionales:
La ingestión produce un fuerte efecto cáustico en la boca y la faringe, así como el peligro de
perforación del esófago y del estómago.
bibliografia
http://quimicaparatodos.blogcindario.com/2009/09/0006http://www.quimicaorganica.org/acidos-carboxilicos/201-nomenclatura-acidos-carboxilicos.html8-los-acidos-carboxilicos.html









